فرآیند تولید کلر آلکالی
- فرآیند تولید کلر آلکالی
صنعت کلر – آلکالی یا (کاستیک -کلرین) یکی از بزرگترین تکنولوژی های الکتروشیمیایی در جهان می باشد .این صنعت ، یک فرآیند فشرده انرژی بوده و دومین مصرف کننده بزرگ الکتریسیته ( 2400 بیلیون کیلو وات ) در میان صنایع الکترولیتی می باشد .در سال 2006 ، حدود 84% از کل ظرفیت کلرین دنیا یعنی حدود 59 میلیون متریک تن از آن به شکل الکترولیتی و با استفاده از سلول های دیافراگمی و غشایی تولید گشته ، در حالی که حدود 14% از آن با استفاده از سلول های جیوه ای ساخته شده است .
کلر بواسطه الکترولیز محلول کلرید سدیم تولید گشته که غالبا آن را “ آب شور“ می نامند از این رو ، هنگامی که کلرید سدیم در آب حل می گردد ، به یون های مثبت سدیم و یون های منفی کلرید تفکیک می گردد .یون های کلرید در آند اکسید گردیده تا بتوانند گاز کلر را بوجود آورده و ملکول های آب در کاتد کاهش یافته تا یون های منفی هیدروکسید و گاز هیدروژن را تشکیل دهند .یون های سدیم موجود در محلول و یونهای هیدروکسید در کاتد تولید گشته و اجزای هیدروکسید سدیم را تشکیل داده و در طی فرآیند الکترولیز کلرید سدیم شکل می گیرد . (واکنش های شیمیایی که در سلول رخ می دهند در ضمیه نشان داده شده اند .)
کلر به شکل الکترولیتی و با کاربرد سه نوع سلول الکترولیتی تولید می گردد . تفاوت عمده میان این تکنولوژی ها ، در روشی است که بوسیله آن از مخلوط شدن گاز کلر و هیدروکسید سدیم با یکدیگر جلوگیری می شود ، تا بدین وسیله از تولید محصولاتی خالص اطمینان حاصل کنند . بدینسان ، در سلول های دیافراگمی ، آب شور از قسمت آند از درون جداساز به سمت قسمت کاتد جریان پیدا می کند ، جنس ماده جداسازمی تواند از جنس آزبست یا ترکیب پلیمر اصلاح شده آزبست باشد که بر روی کاتد سوراخ شده رسوب کرده است . از طرف دیگر ، در سلول های غشایی ، از یک غشا مبادله کننده یونی به عنوان جداساز استفاده می شود . جداسازی آنولیت –کاتولیت درسلولهای دیافراگمی وغشایی انجام میشود و اینکار ، به ترتیب ، با استفاده از جداسازها و غشاهای مبادله کننده ی یونی صورت می گیرد، در حالی که سلول های جیوه ای در بر دارنده ی هیچ گونه دیافراگم یا غشایی نمی باشند و جیوه خودش به عنوان یک جداساز عمل می کند . آند در تمام تکنولوژی ها از جنس فلز تیتانیوم است که با یک لایه ی کاتالیزوری الکترولیتی اکسیدهای ترکیب شده روکش شده است . تمام سلول های امروزی ( از سال 1970 ) از این به اصطلاح “آندهایی با ابعاد ثابت “استفاده می کنند . سلول های پیشین ، از آندهای کربنی استفاده می کردند . کاتد معمولاً در سلول های دیافراگمی از جنس فولاد ، در سلول های غشایی از جنس نیکل ، و درسلول های جیوه ای از جنس جیوه است .
سلول جیوه ای ، انتهای فولادی داشته و کناره های فولادی آن با پلاستیک پوشانده شده است ، به همین ترتیب انتهای جعبه با آب شور و جیوه تغذیه شده وراه خروج بخار آن با پلاستیکی قابل انعطاف یا فولادی روکش شده با پلاستیک ، پوشانده شده است .آندهای فلزی تنظیم پذیر از بالا آویخته شده اند ، و جیوه ( که تشکیل دهنده کاتد سلول است ) بر روی کف شیبدار جریان می یابد . جریان از کف فولادی به سمت جیوه در حال حرکت ، جاری می گردد .
آب شور اشباع شده که از انتهای جعبه تغذیه شده ، در آند الکترولیز می گردد تا گاز کلر راکه از بخش بالایی ظرف حرکت نموده و سپس خارج می گردد تولید نماید . یون سدیم واکنش هایی با جیوه انجام داده تا بتواند ملغمه سدیم ( که شامل آلیاژ جیوه و سدیم می باشد )را شکل دهد ، که از انتهای جعبه به سمت مخزن استوانه ای عمودی جریان می یابد . در حدود 0.25% تا 0.5% ملغمه سدیم ، در سلول تولید می گردد . ملغمه سدیم ، در جداساز با آب واکنش نشان داده ، و با ذرات گرافیت ( سرب سیاه ) بسته بندی و تولید کاستیک سودا و هیدروژن می نماید . هیدروژن ، با بخار آب اشباع شده ، و از بالا به همراه بخارات جیوه خارج می گردد . سپس کاستیک سودا ، که محتوی کاستیک 50% می باشد ، از جداساز به سمت خارج جریان می یابد . آب شور واکنش نیافته ، از انتهای خروجی جعبه به خارج جریان می یابد . بعضی سلول ها با مجرای کلرینی و آنولیتی در انتهای جعبه در نظر گرفته شده اند ، که در مخزنی تهی شده از آب شور جدا گشته اند .جیوه موجود در جداساز به سمت سلول با لوله برگردانده می شود .
واکنش های الکتروشیمیایی و شیمیایی که در سلول های جیوه رخ می دهند
[1]2Cl⁻==> Cl2 + 2e⁻ واکنش آندی
[2]2Na⁺+ 2Hg + 2e⁻==> 2Na (in Hg) واکنش کاتدی
[3]2Cl⁻+ 2Na⁺+ 2Hg ==> Cl2 + 2Na (in Hg) سرتاسر واکنش سلول
[4]2Na (in Hg) + 2H2O ==> H2 +2NaOH + Hg واکنش تجزیه ای
[5]2NaCl + 2H2O ==> Cl2 +2NaOH + H2 تمام مراحل واکنش
واکنش های الکتروشیمیایی و شیمیایی که در سلول های دیافراگمی و غشایی رخ می دهند
[1]2Cl⁻==> Cl2 + 2e⁻ واکنش آندی
[6]2H2O + 2e⁻==> 2OH⁻+ H2 واکنش کاتدی
[7]2Cl⁻+ 2H2O ==> Cl2 + H2 + 2OH⁻ تمام واکنش یونی
[5]2NaCl + 2H2O ==> Cl2 +2NaOH + H2 تمام واکنش
[8]Cl2 + 2NaOH ==> NaOCl + NaCl + H2O واکنش فرعی
[9]3NaOCl ==> NaClO3 + 2NaCl واکنش فرعی
واکنش {9} در بردارنده ی محصول کاستیک با کلرات می باشد .
واکنش های شیمایی که در پردازش آب شور رخ می دهند
[10]CaSO4 + Na2CO3 ==> CaCO3 +NaSO4 CaCO3رسوب
[11]MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl Mg(OH)2رسوب
- سلول های دیافراگمی
سلول دیافراگمی ، یک جعبه مستطیلی با آندهای فلزی می باشد که از انتها توسط صفحه های مسی ،که حامل جریان مثبت اند ، نگه داشته شده است . کاتدها ، تورهای فلزی یا صفحه های منگنه شده ای هستند که از یک انتها به انتهای دیگر مخزن مستطیلی وصل شده اند .آزبست ، که مانند یک دوغاب در وانی پراکنده می شود ، رسوب های موجود در کاتدها را مکیده و تشکیل دیافراگم می دهد . آب شور اشباع شده ، به قسمت آند وارد شده و گاز کلر در طی الکترولیز در آند آزاد گشته ، و از بخش آندی خارج می گردد . این ماده با بخار آب تحت کمی فشار آب ، روی آنولیت اشباع می گردد . یون های سدیم از قسمت آند به قسمت کاتد ، با جریان محلول و مهاجرت الکتریکی ، به گونه ای انتقال پیدا کرده که در آن جا با یون های هیدورکسید ترکیب گشته و در طول شکل گیری هیدروژن از ملکول های آب ، در کاتد تولید می گردند .دیافراگم در برابر برگشت مهاجرت یون های هیدروکسید از خود مقاومت نشان داده ،که در غیر این صورت با کلر موجود در قسمت آند واکنش نشان می دهد .در قسمت کاتد ، غلضت هیدروکسید سدیم حدود 12% و غلضت نمک 14% می باشد . همچنین مقداری کلریت سدیم در قسمت آند تشکیل می گردد که به PH آنولیت بستگی دارد .
در سلول غشایی ، مبادله یونی غشا باعث جداسازی قسمت آند و کاتد می گردد . معمولاً جداکننده ، یک غشای دولایه ای از جنس پرفلئورو کربوکسیلیک و پرفلئورو سولفونیک باغشای اسیدی می باشد که با فشار بین آند و کاتد قرار گرفته است .آب شور اشباع شده ، در قسمت آند ، در جایی که کلر در آند آزاد گشته، و یون سدیم به قسمت کاتد مهاجرت می کند ، تعذیه می گردد .برعکس در سلول های دیافراگمی ، فقط یون های سدیم و مقداری آب از طریق غشا مهاجرت می کنند . کلرید سدیم تحت واکنش قرار نگرفته و سایر یون های ساکن ، در آنولیت باقی می مانند .حدود 30-32% از کاستیک سودا در قسمت کاتد تغذیه می گردد ، در این جا ، یون های سدیم با یون های هیدروکسید واکنش نشان داده و در طی مسیر تغییر شکل گاز هیدروژن از ملکول های آب تولید می گردند . این شکل کاستیک ، سبب افزایش غلظت محلول کاستیک تا حدود 35% می شود . گاز هیدروژن ، با آب اشباع گشته و از قسمت کاتولیت خارج می گردد . فقط بخشی از محصول کاستیک سودا از قسمت کاتد برداشته می شود. کاستیک باقی مانده تا حدود 32% رقیق گشته و به قسمت کاتد باز می گردد.
بدینسان، تمام سه تکنولوژی سلولی اصلی، تولید کلر را در آند و تولید هیدروژن را به همراه هیدروکسید سدیم (کاستیک سودا) در قست کاتد به همراه دارند ( یا در راکتور جداگانه ای برای سلول های جیوه ای، شکل سلول جیوه ایی را نگاه کنید ) .تفاوت محرز میان تکنولوژی ها در روشی است که به وسیله آن از ترکیب جریان های آنولیت و کاتولیت با یکدیگر جلوگیری می نماید. جداسازی در سلول دیافراگمی و بوسیله یک جداکننده صورت می گیرد ، و در سلول غشایی این کار توسط غشای مبادله یونی انجام می شود. در سلول های جیوه ای ، کاتد خودش به عنوان جداساز عمل می کند و این کار را با شکل دهی آلیاژ سدیم و جیوه ( ملغمه سدیم ) انجام می دهد که متعاقباً با آب واکنش نشان داده تا هیدروکسید سدیم و هیدروژن را در راکتور جداگانه ای تشکیل دهد .
مقایسه ویژگی عملکرد این سه تکنولوژی در ضمیمه به همراه شکل طرح کلی فرآیند هر یک از تکنولوژی های سلولی نشان داده شده است . تکنولوژی ابتدایی که در حال حاضر برای توسعه در آینده یا جایگزینی گردش موجود به کار می روند ، تکنولوژی غشای سلولی می باشد . تامین کنندگان اصلی تکنولوژی غشا سلولی ، عبارتند از :
Thyssenkrupp ,INEOS, Asahi Chemicals
تکنولوژی ِDeNora یک تامین کننده ی منحصر به فرد تکنولوژی سلول دیافراگمی و غشایی می باشد که نهایتا توسط شرکت تایسن کروپ آلمان خریداری شد. شرکت INEOS انگلستان نیز همزمان هم به صورت لایسنسورو هم به صورت تولید کننده کلرآلکالی و PVC در دنیا شناخته میشود. هایپ احتمال خیلی کمی وجود دارد که کسی یک طرح سلول دیافراگمی یا جیوه ای جدیدی را در آینده بوجود آورد . شکل ۳-۱ و ۳-۲ اتاق های سلولی را به همراه سلول های دیافراگمی و کلر –آلکالی غشایی نشان میدهند.

شکل ۳- ۱ نمونه اتاق های سلول های دیافراگمی

شکل ۳- ۲ نمونه ایی از سلول های الترولیز غشایی
- پردازش کلـر
گاز کلر قسمت آند در بر دارنده رطوبت ، محصول فرعی به نام اکسیژن و مقداری هیدروژن برگشت یافته است . به علاوه ، اگر آب شور خاصیت قلیایی داشته باشد ، شامل دی اکسید کربن و مقداری اکسیژن و نیتروژن ناشی از نشت هوا از طریق فرآیند یا لوله کشی می باشد .
کلر ابتدا تا دمای 60درجه فارنهایت ( 16 درجه سانتی گراد ) سرد می شود و از داخل بخار زدا رد گشته تا قطره های کوچک آب و ذرات ریز نمک و سولفات سدیم را بزداید . گاز سرد شده به سمت برج در حال چرخش اسید سولفوریک که به طور پی در پی در حال انجام فعالیت است ، می رود .معمولاً ، از سه برج برای زدودن بخار استفاده می شود . سپس کلر خشک شده ، قبل از این که در دمای کم فشرده و تبدیل به مایع شود ، از داخل بخارزدا رد می شود .گاز متراکم نشده، یا گاز قابل استشمام، را برای تولید هیپوکلر یت یا اسید هیدروکلریک به کار می برند .اگر بازاری برای اسید هیدروکلریک وجود نداشته باشد ، گاز قابل استشمام به وسیله کاستیک سودا یا آهک (هیدروکسید کلسیم ) خنثی گشته تا هیپوکلریت را تشکیل دهد .هیپوکلریت یا به عنوان ماده رنگبر فروخته شده یا برای تشکیل نمک و اکسیژن تجزیه می گردد .
- پردازش آب شور
کلرید سدیم که به شکل نمک جامد موجود می باشد ، یا از معدن استخراج شده و یا با تبخیر آب شور بدست می آید . همچنین این ماده به شکل مایع و در نتیجه ی معدن کاری محلول گنبدهای نمکی نیز به دست می آید. غلظت ناخالصی های نمک، که برای انجام عملیات سلول های الکترولیتی با بازدهی جریان بالا باید زدوده گردند، متفاوت است. عمده ناخالصی ها عبارتند از : کلسیم ، منیزیم و سولفات . سایر ناخالصی های جزیی ، که نامطلوب می باشند و به نوع فرآیند انتخابی کلرآلکالی مربوط میباشند، شامل: باریم، استرانسیم ، منگنز ، آلومینیم ، سیلیس ، آهن ، وانادیم ، کروم ، مولیبیدن ، تیتانیوم و … می باشد.
محلول آب شور معدن یا نمک جامد حل شده در حلال نمک، در راکتور با کربنات سدیم و کاستیک سودا
عمل آوری شده و باعث رسوب کربنات کلسیم و هیدروکسید سدیم میگردد. این رسوبات در منطقه رسوبی، رسوب میکنند. جریان زیر زمینی حامل دوغاب جامد، برای فیلتر شدن لوله کشی میشود تا گل و لای آن زدوده شود، یا گاهی در کنار مایع باقی مانده مایع منتشر شده از زمین چیده می شود .رسوبات کربنات کلسیم سنگین بوده و با خود هیدروکسید آلومینیم ، منیزیم، استرانسیم و .. را به همراه دارد .جریان جاری در حوزه رسوبات ، که حدود 10-50 قسمت در میلیون از جامدات معلق را داراست، فیلتر می گردد . در فرآیند جیوه ای و دیافراگمی، این آب شور کافی بوده، و میتواند برای دستگاه الکترولیز آماده گردد.
در تمامی فرآیندها ، آب شور فیلتر شده گرم میگردد و از درون بستر نمک موجود در دستگاه اشباع کننده عبور میکند تا غلظت نمک را پیش از تقویت آن برای فرستادن به دستگاه الکترولیز افزایش دهد. در بعضی زمینها ، آب شور تقویت شده، اسیدی میگردد تا کارایی جریان سلولی را بهبود دهد. اسیدی کردن، سبب کاهش خاصیت قلیایی شده که در غیر این صورت ممکن است با کلر، در قسمت آنولیت، واکنش کرده و تشکیل کلرات دهد .
مشخصات آب شور فرآیند سلول غشایی، خیلی دقیق تر از فرآیندهای جیوه ای و دیافراگمی می باشد ، و سبب ایجاد ناخالصی هایی در بعضی قسمت ها می گردد . این رویداد توسط فیلترینگ آب شور ، در فیلتر ثانویه از پیش پوشانده شده فیلتر می گردد . از صمغ برای مبادله یونی استفاده می شود تا کلسیم ، منیزیم ، باریم ، و ناخالصی های آهن را از بین ببرد . همچنین این امکان وجود دارد که آلومینیوم را با مبادله یونی بزدایند . غالباً ، آلومینیم و سیلیس را با افزدودن کلرید منیزیم به آب شوری که از حلال نمک خارج می شود ، می زدایند .
آب شور خالی شده در اثر فرآیندهای سلول جیوه ای و غشایی ، با خود کلر غیر قابل حل را حمل می کند . این آب شور ، اسیدی گشته تا قابلیت حل کلرین را کاهش دهد ، و سپس در یک دستگاه دی کلرینه کننده ی آب شور ، دی کلرینه می شود . آب شور دی کلرینه شده به منابع آب شور باز گردانده می شود تا برای معدن کاری محلول یا حل کردن نمک مورد استفاده قرار گردد . اگر فرآیندهای غشایی و دیافراگمی باهم در یک محل صورت گیرند ، آب شور دی کلرینه شده می تواند ، پیش از این که به سلول های دیافراگمی فرستاده شود ، به دستگاه اشباع کننده جهت اشباع دوباره ارسال شود.
در حقیقت سه روش الکترولیز برای استخراج هیدروکسید سدیم از آب نمک وجود دارند که عبارتند از :
1-فرآیند جیوه ای 2- فرآیند دیافراگمی 3- فرآیند غشایی
1-فرآیند جیوه ای
فرآیند جیوه ای متضمن کاربرد سلول جیوه تحت الکترولیز می باشد که سبب تجزیه کلرید سدیم ( نمک طعام ) و تغییر شکل آن به هیدروکسید سدیم می گردد . این فرآیند به طور معمول مربوط به فرآیند کاستنر–کلنر می باشد . سلول جیوه ، جیوه مایع را به عنوان کاتد به کار برده ، تا بدین گونه بتواند سدیم را کاهش داده و هم زمان جیوه را در برگیرد و آلیاژ جیوه ، یا محلول آن را تشکیل دهد.آب شور ( آب نمک ) به آرامی در داخل مخزن جریان پیدا کرده و با کلرین ، به شکل گازی متصاعد گردیده و در بالا انباشته می گردد . محفظه بالایی به عنوان سلول الکترولیز شناخته شده و محفظه پایینی فقط شامل آب خالص می باشد .
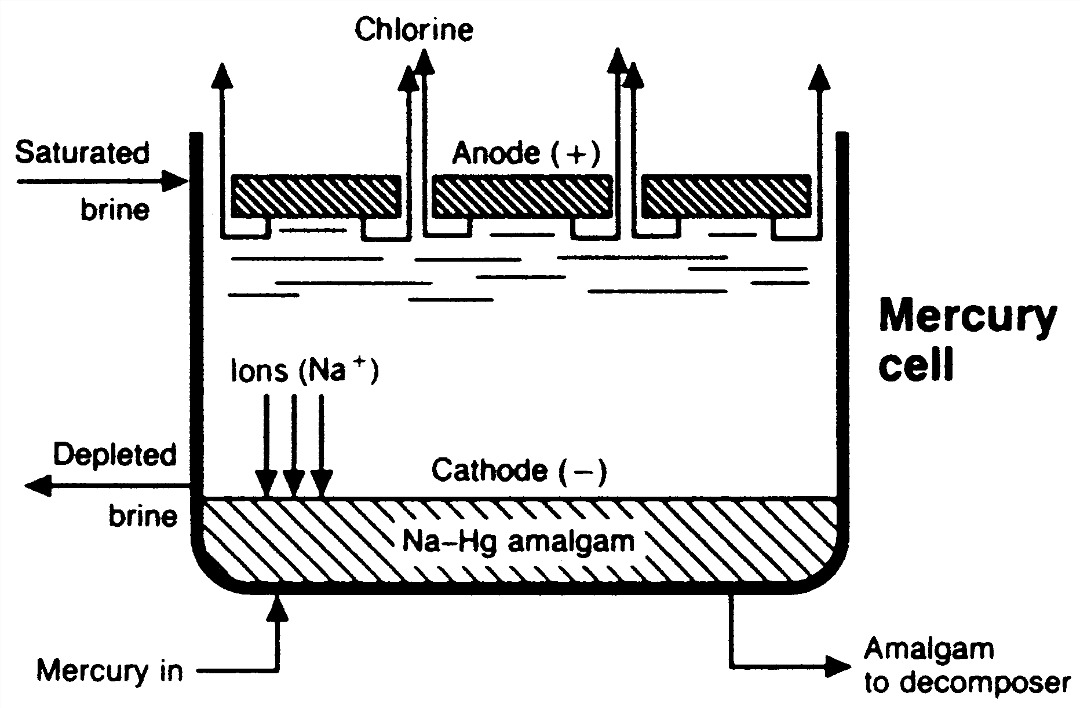
شکل ۳-۳ سلول جیوه ای
در کاتد ( که در محفظه ی بالایی شکل قرار دارد و جریان جیوه در آن بر خلاف جهت حرکت عقربه های ساعت می باشد ) واکنش زیر به وقوع می پیوندد :
(در جیوه حل شده و تشکیل آلیاژ جیوه می دهد) Na⁺(aq) + e⁻→ Na
جیوه از طبقه ی شیبدار محفظه با ترمینال ( پایانه ) منفی منبع ولتاژ فرو رفته در آن جریان پیدا می کند . آلیاژ جیوه ، به دلیل ولتاژ به کار گرفته شده در آن ، با آب شور واکنش نشان نمی دهد .
در آند ( که همچنین در محفظه بالایی شکل قرار دارد ، می تواند بلوک کربنی یا تیتانیومی باشد ) واکنش زیر رخ می دهد:
گاز کلر تولید شده از اکسیداسیون ، به بالا رفته و در آن جا جمع می گردد . آندها در فاصله ای کاملاً نزدیک به جیوه معلق بوده تا بدین ترتیب بتوانند جریان جاری بزرگی را بوجود آورند .کل واکنش به وقوع پیوسته در محفظه بالایی عبارت است از :
(در جیوه حل گشته )
جیوه با سدیم در آن حل گشته و سپس به سمت محفظه پایینی که فقط شامل آب جریان می یابد .سدیم بدون هیچ گونه پتانسیل الکتریکی بین آب و آلیاژ جیوه ، با آب واکنش داده و هیدروکسید سدیم را تشکیل می دهد ، سدیم خالص واکنش زیر را صورت می دهد :
آلیاژ جیوه ، هنگامی که آب در خلاف جهت حرکت عقربه های ساعت جریان دارد ، در جهت حرکت عقربه ساعت جریان می یابد . آب با سدیم حل می شود همانطور که واکنش نشان می دهد . این کار سبب تشکیل محلول هیدروکسید سدیم و گاز هیدروژن می گردد . محلول هیدروکسید سدیم از سمت چپ در حالی به خارج جریان می یابد که گاز هیدروژن گرفته شده و در داخل سیلندر جمع و متراکم گردیده است یا به کارخانه دیگری لوله کشی گشته است .پس از آن هیدروکسید سدیم خالی گشته و جای آن را آب می گیرد .هنگامی که سدیم در حال انجام واکنش بوده ، جیوه مخزن را ترک کرده است ، درنتیجه جیوه می تواند دوباره در سلول الکترولیز یا محفظه ی بالایی مورد استفاده قرار گیرد .
به طور کلی سلول های جیوه شامل یک سلول بزرگ می باشند ( همان گونه که در شکل بالا نشان داده شده ) که درازای آن حدود 15 متر و پهنای آن 1 متر است . این سلول ها در ولتاژی بین 3 و 4 ولت به فعالیت پرداخته که این رقم در مقایسه با مقدار الکتریسته ای که در کارخانجات به کار می رود ،مقدار ناچیزی به حساب می آید . محلول آن نیز تا حدود 50% تغلیظ گردیده و یا به همین شکل فروخته شده یا تبخیر گشته تا خشک شود و محصول جامدی را بوجود آورد . به علت این که آب خالص با آلیاژ جیوه واکنش نشان می دهد ،هیچ گونه عدم خلوص محصولی در مورد کلراید صادق نمی باشد .
از مزایای این فرآیند ، تولید سدیم خیلی خالص و اجتناب از کار برد آزبست ( پنبه نسوز ) می باشد. لیکن ، عیب این فرآیند ، این است که چنین جیوه ای گاهی به اندازه 100 تا 200 گرم در هر تن از محصول NaOH در محیط رها می گردد . از لحاظ نظری ، جیوه فقط باید ، مانند زمانی که با تلمبه به سلولش بر می گردد ، بازیابی گردد . لیکن ، یک انتقال مکانیکی غیرقابل اجتنابی از جیوه به محلول آب شور وجود دارد ، که سبب تخلیه آن در محیط و برگشت آن به اقیانوس یا منابع اب زیر زمینی می گردد . جیوه فلزی تا حد زیادی حل نشدنی است ، بنابراین مشکلی را بوجود نمی آورد و فقط در کف اقیانوس یا منابع زیر زمینی باقی می ماند . با وجود این ، باکتری هایی وجود دارند که جیوه را به مواد مرکبی مانند دی متیل جیوه تبدیل نموده ، به گونه ای که این ماده می تواند توسط موجودات زنده مورد استفاده قرار گیرد و با غلظت بیشتری در طی مسیر خود وارد زنجیره غذایی گردد. بنابراین این مسئله منجر می شود ، مصرف کنندگانی که ماهی می خورند و یا موجوداتی که از منابع آبی زیرزمینی استفاده میکنند،مقداری از جیوه را نیز دریافت کنند که بر سیستم عصبی آنان تاثیر گذاشته ، و منجر به آسیب مغزی می گردد .این مسئله سبب اعمال محدودیت هایی بر مقدار جیوه ای که تخلیه می گردد ، یعنی یک گرم در هر تن NaOH، شده است . نتیجاً به ندرت می توان سلولهای جیوه ای ساخته شده برای انجام این کار را مشاهده کرد.
2-فرآیند دیافراگمی
فرآیند دیافراگمی از الکترودهای ساکن استفاده می کند –مثلاً از الکترود تیتانیوم برای مقاومت در برابر تغییر شکل کلر و نیز از کاتد شبکه ایی مانند آهنی که تحت تاثیر محلول هیدروکسید قرار نمی گیرد یون های کلراید به سمت آند حرکت کرده و در اثر اکسیداسیون به گاز کلر تبدیل می گردند . از این رو واکنش در آند را به شرح زیر می توان بیان کرد :
یون های سدیم به سمت کاتد رفته ، لیکن این یون ها خیلی محکم تر از آن هستند که بتوان آن ها را کاهش داد : در عوض آب به گاز هیدروژن و یون های هیدروکسید کاهیده شده و بنابراین محلول هیدروکسید سدیم شکل می گیرد . بنابراین در کاتد واکنشی که صورت می گیرد عبارت است از :
2 H2O (l) + 2e⁻→ 2OH⁻+ H2 (g)
کل این فرآیند ، که شامل یون های ناظر می باشد به شرح زیر می باشد :
برابری کامل یونی با گونه خنثی آن به شرح زیر می باشد :
در فرآیند الکترولیز ، گازهای کلر و هیدرژن تولید گشته و محلول هیدروکسید سدیم را از خود به جا می گذارد . این فرآیند ، هم کلر و هم هیدروکسید سدیم تولید می کند . این مسئله اغلب به صنعت کلر –آلکالی برمیگردد که درآن هر دو محصول از اهمیت یکسانی برخوردارمیباشند . هیدروژن نیز به سایر صنایعی که به آن نیازمند هستند ( مانند هیدروژناسیون روغنها برای تولید مارگارین و .. ) فروخته می شود . مسائلی که در حین انجام کار بوجود می آیند و در طراحی سلول نیاز به مشخص نمودن دارند ، عبارتند:
- جدا نگه داشتن گازهای H2و Cl2، زیرا در صورت تماس آنها با یکدیگر ، به شدت واکنش نشان می دهند .
- کاهش تماس میان یون هیدروکسید و کلر در محلول به شکل هایOH⁻ و Cl2، زیرا سبب تولید کلر ناخواسته ، ClO⁻ ، می گردند .
- به حداقل رساندن مقدار کلرید موجود در محلول نهایی هیدروکسید .
شکل زیر نشان دهنده ساختار یک سلول دیافراگمی می باشد . دیافراگم ، مانعی متخلخل میان بخش های آند و کاتد می باشد که تمایل دارد یون سدیم را در آن جاری نموده وبدین ترتیب توازنی در یون هیدروکسید شکل گرفته ایجاد و روند جریان الکتریسیته را در مدار کامل نماید و نیز سبب انباشته شدن هیدروکسید سدیم در قسمت کاتدی می گردد . دیافراگم از آزبست ساخته شده که در نتیجه باعث می شودکه در اثر محلول هیدروکسید آسیب نبیند . کلر گازی موجود در قسمت آند ، سبب تقلیل محلول آب شور کلراید گشته و منجر به جریان آهسته آب شور تازه به این قسمت شده و سبب زدودن آب شور تقلیل یافته می گردد . وجود یک مانع سبب جداسازی گازهای H2و Cl2شده و در نتیجه می توان از آن ها در صنایع دیگری بهره جست .
مقدار ولتاژی که از میان الکترودها عبور می کند ، 3.5 و 5 ولت می باشد . هر سلول بسیار کوچک است ، بنابراین شکاف بین الکترودها و دیافراگم نیز کوچک است که این سبب به حداکثر رساندن جاری شدن جریان در آن
می گردد . تعداد زیادی از سلول ها در کنار یکدیگر آورده شده اند که باعث می گردد که فرآورده ها در حوزه یک محل مشابه تغذیه گردند و در آن جا آنها فقط نیازمند تعیین یک نقطه ی جهش برای هر محصول و یک نقطه ورودی برای آب شور می باشند .
محلولی که در آخر برده می شود ، هم حاوی هیدروکسید سدیم و هم کلرید سدیم می باشد .آب از این محلول ، تا زمانی که حجم آن 50% هیدروکسید سدیم شود ، تبخیر می گردد . در این مرحله ، بیشتر کلرید سدیم متبلور گردیده ، بنابراین می تواند صاف گشته و محلول تقریباً خالص هیدروکسید سدیم را فروخته یا تبخیر کنند تا خشک شود ( مانند وضعیتی که در سلول جیوه ای بود ) و هیدروکسید سدیم جامد تولید کند . این محصول شامل حدود یک تا 2 درصد کلرید سدیم می باشد .
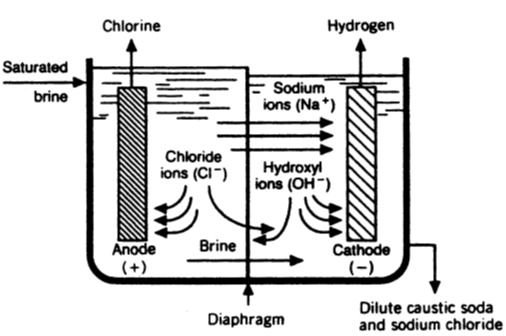
شکل ۳- ۴ سلول دیافراگمی
مزایای این فرآیند این است که مقدار زیادی از هیدروکسید سدیم و کلر ، که جزو دو ماده شیمیایی صنعتی با تقاضای بالا می باشند ، با هزینه ای معقول و سطح کاملاً قابل قبولی از درجه خلوص می توانند تولید گردند . هر چند ، این فرآیند معایبی نیز در پی دارد :
- همیشه مقدار کمی از کلرید در فرآورده NaOH وجود داشته که به همراه مقدار کمی از آزبستی که در ساختن و استفاده ازسلولها رها می گردد ، جزو مشکلات سلامتی و محیطی به حساب می آید .
- همچنین احتمال دارد هیپوکلریت که یک اکسید کننده قوی می باشد ، در محلول آب شور باقی مانده وجود داشته باشد و به این دلیل باید پیش از تخلیه آب شور در محیط ، از آن زدوده شود.
3-فرآیند غشایی
سلول غشایی یک نوع سلول دیافراگمی با دیافراگم بهبود یافته است که آن را “ غشا“می نامند . این ماده از پلی تترا فلورو اتیلن ساخته شده ، و از آن یک پلاستیک غشایی می سازند ، که تعدیل شده تا بتواند در بر گیرنده ی گروه های آنیونیک شود و به عنوان غشای مبادله کننده یونی عمل نماید .این کار به یون های سدیم اجازه می دهد که از میان آن بگذرند ، اما به یون های هیدروکسید یا کلرید این اجازه را نمی دهد .پلی تترا فلورو اتیلن ، بسیار راکد بوده ، از این رو میتواند برای مدت های مدیدی در محلول های هیدروکسید غوطه ور بماند .
از این رو ، واکنش های مشابه ای مانند فوق در سلول دیافراگم به وقوع می پیوندد لیکن حاصل آن هیچ گونه محصول فرعی ناشی از کلرید سدیم ، که در اثر جلوگیری غشایی عبور یون های کلرید و هیدروکسید ایجاد شده ، نمی باشد .
در اثر این فرآیند ، هیدروکسید سدیم کاملاً خالصی ( که حداکثر فقط شامل حدود 0.02% کلرید سدیم می باشد) تولید می گردد ، به گونه ای که هیچ گونه عدم خلوصی از کلرید در آن وجود نداشته ، و واقعا هیچ گونه اکسید شدگی در آب شور مصرف شده وجود ندارد . بعلاوه ، در این فرآیند هیچ گونه خطر ناشی از کار با آزبست یا جیوه وجود ندارد.
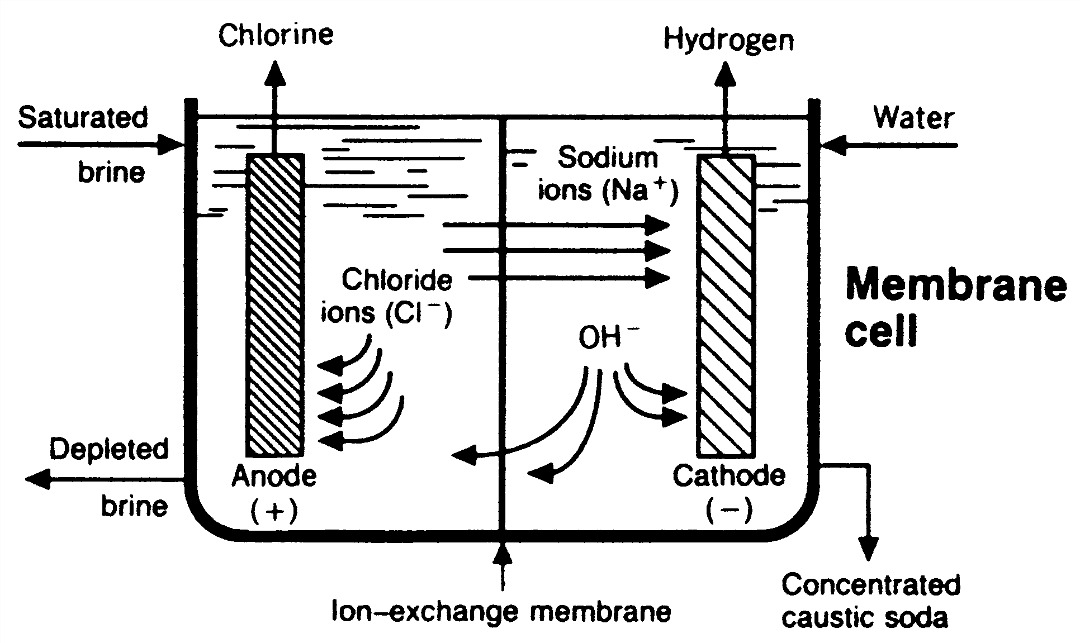
شکل ۳- ۵ سلول غشایی
فرآیند کاربرد الکترولیز برای توسعه هیدروکسید سدیم ، در تمام طرح های کلر – آلکالی سازگار بوده و به دلیل درجه خلوص زیاد هیدروکسید سدیم ، هزینه های مشابه با سلول دیافراگمی (منطقی) داشته و هیچ گونه اثری بر محیط نیز نداشته است.مزایای فرآیند غشایی رجحان بیشتری نسبت به فرآیندهای جیوه ای و دیافراگمی داشته و نیز معایب ناچیزی دارد که همین امر ثابت می کند که این فرآیند بهترین تکنیک برای استخراج هیدروکسید سدیم می باشد .